Bioavailability og bioequivalence er to nøkkelforklaringer når du skal forstå hvorfor et generisk legemiddel virker akkurat som det originale. De handler ikke om ingrediensene - de er de samme. Det handler om hvor raskt og hvor mye av stoffet som faktisk kommer inn i blodet og blir tilgjengelig for kroppen. Uten disse to begrepene ville vi ikke kunnet stole på at et billigere generisk legemiddel er like trygt og effektivt som det dyre merkevareproduktet.
Hva er bioavailability?
Bioavailability handler om én enkelt ting: hvor mye av en legemiddeldose som faktisk trenger inn i blodstrømmen og blir tilgjengelig for kroppen. Tenk på det som en «effektivitetsprosent» for hvordan legemiddelet blir absorbert.
For eksempel: Hvis du tar en tablett med 100 mg stoff, men bare 60 mg av det ender opp i blodet, så har du en bioavailability på 60%. Resten blir enten ikke absorbert i tarmen, eller ødelegges i leveren før den kommer ut i kretsløpet - det kalles «first-pass metabolism».
Det finnes to typer bioavailability:
- Absolutt bioavailability: Sammenligner en oral dose (tablet, kapsel) med en intravenøs dose (injeksjon). Injeksjonen er alltid 100% bioavailable, fordi stoffet går direkte inn i blodet.
- Relativ bioavailability: Sammenligner to ulike former av samme legemiddel - f.eks. en tablet mot en væske, eller et merkevareprodukt mot et generisk alternativ.
Bioavailability måles med to nøkkeltall:
- AUC (Area Under the Curve): Hvor mye stoff som er tilstede i blodet over tid. Det gir deg en helhetlig forståelse av total eksponering.
- Cmax: Hva den høyeste konsentrasjonen i blodet er. Det forteller deg hvor raskt stoffet blir absorbert.
Disse to verdiene er grunnlaget for alt annet - inkludert bioequivalence.
Hva er bioequivalence?
Bioequivalence er ikke et egenskap til ett legemiddel. Det er en sammenligning mellom to legemidler - vanligvis et generisk produkt og det originale merkevarelegemiddelet.
En legemiddelprodusent som vil lage et generisk alternativ må vise at deres produkt gir akkurat samme mengde stoff i blodet, med akkurat samme hastighet, som det originale. Hvis det er tilfellet, så er de bioequivalent.
Det er ikke nok at de inneholder samme stoff. En tablet fra et annet firma kan ha forskjellige fyllestoffer, konsistens, eller dekning - og det kan endre hvor raskt stoffet frigjøres. Bioequivalence sjekker nettopp om disse forskjellene har noe å si for kroppen.
For å godkjenne et generisk legemiddel, må en studie vise at:
- For AUC: Den 90% konfidensintervall for forholdet mellom generisk og originale må være mellom 80% og 125%.
- For Cmax: Samme regel - 80% til 125%.
Dette kalles «80/125-regelen». Det betyr at den generiske varianten kan ha opptil 20% mindre eller 25% mer stoff i blodet enn det originale - og fortsatt anses som likeverdig. Det er ikke en tilfeldig tall - det er basert på tusenvis av studier som viser at innenfor dette området, er klinisk virkning og sikkerhet identisk.
Hvorfor 80/125? Ikke 100/100?
Det er en vanlig forståelsesfeil at bioequivalence betyr «nøyaktig lik». Det gjør det ikke. Det betyr «tilstrekkelig lik for å virke likt».
Grunnen til at vi ikke krever 100% likhet er at kroppen har naturlig variasjon. To personer tar samme tablet - og får forskjellige blodkonsentrasjoner. Det er normalt. Det samme gjelder for to ulike tabletter fra samme produsent - det er små variasjoner i produksjonen.
Den tidligere metoden brukte et «±20%» tillegg - det var feil. Farmakokinetikk følger multiplikative mønstre, ikke additiv. Det vil si: Hvis en person har 10% høyere absorpsjon enn gjennomsnittet, så er det ikke +10 mg, men +10% av den faktiske mengden. Derfor ble 80/125-regelen innført - den er statistisk robust og basert på virkelige data.
Denne regelen har fungert i over 30 år. I USA ble over 750 generiske legemidler godkjent i 2022 - alle måtte oppfylle dette. Og bare 0,3-0,5% av pasienter rapporterer problemer etter omstilling - og mange av disse er ikke relatert til bioequivalence, men til psykologiske faktorer eller andre helseproblemer.
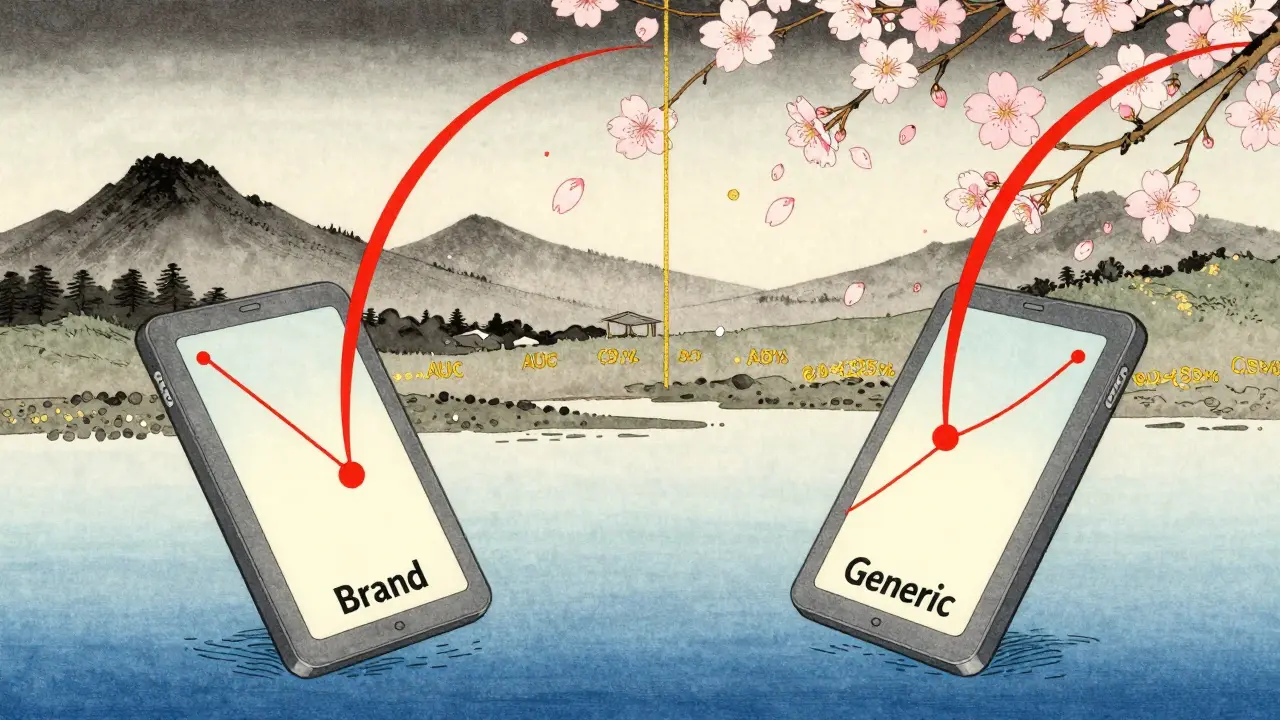
Hvordan testes bioequivalence?
Det er ikke noe en farmasi kan gjøre i bakrommet. Det krever streng vitenskapelig metode.
En standard bioequivalence-studie:
- Har 24-36 friske frivillige deltakere (ikke pasienter).
- Er en «crossover-studie»: Hver deltaker tar både det originale og det generiske legemiddelet - i tilfeldig rekkefølge - med en pause mellom.
- Skjer under nøyaktig kontrollerte forhold: Fasting (tom mage), samme vannmengde, samme tidspunkt.
- Blodprøver tas 12-18 ganger over 72 timer for å tegne opp konsentrasjonskurven.
- Analyseres i laboratorier med høy presisjon - ofte med massespektrometri.
Det tar 3-6 måneder å designe en slik studie. Det er dyrt. Men det er nødvendig. En feil her kan bety at et legemiddel som ikke virker blir solgt som likeverdig - eller at et godt legemiddel blir forkastet.
Unntak: Smale terapeutiske vinduer
Ikke alle legemidler er like. Noen har et «smalt terapeutisk vindu» - det vil si at forskjellen mellom en effektiv dose og en giftig dose er veldig liten.
Eksempler: Warfarin (blodfortynning), levothyroxin (tirroidhormon), phenytoin (epilepsi), lithium.
For disse legemidlene er 80/125-regelen for lett. Derfor krever FDA og EMA en strengere grense: 90-111% for AUC. Cmax kan fortsatt være 80-125%, men AUC må være nøyaktig.
Det er grunnen til at du ofte hører om problemer med generisk levothyroxin. Selv om det er godkjent, så kan små variasjoner i absorpsjon påvirke hormonnivåene i kroppen - og det kan føre til symptomer som tretthet, vektendringer eller hjerteslått.
Derfor anbefales det ofte at pasienter som har vært stabil på et bestemt merkevareprodukt, skal forblive på det samme - ikke bare fordi det er dyrt, men fordi det er trygt. Det er ikke en spørsmål om bioequivalence - det er et spørsmål om klinisk stabilitet.

Er generiske legemidler trygge?
Ja. De er trygge. De er trygge fordi bioequivalence-kravene er strenge - ikke fordi de er enkle.
Et studie fra American Pharmacists Association viste at etter at 1.247 pasienter ble skiftet fra merkevare til generisk antihypertensiv, bare 17 (1,36%) rapporterte problemer. Av disse var bare 4 tilfeller (0,32%) med sikkerhet knyttet til bioequivalence - alle andre var forårsaket av dårlig medisinhåndtering, andre sykdommer, eller psykologiske faktorer.
Et annet survey fra Patients for Better Drugs viste at 87,4% av 1.245 pasienter ikke opplevde noen forskjell. Bare 3,8% av de som rapporterte problemer, hadde en medisinsk bekreftet forbindelse til bioequivalence.
Det betyr at 96% av de som skifter til generiske legemidler, ikke har noen problemer. Og for de som har - er det ofte en spesiell gruppe med smale terapeutiske vinduer.
Hva skjer i fremtiden?
Regulatorer jobber med å gjøre bioequivalence-tester mer effektive. I stedet for alltid å bruke blodprøver, prøver EMA og FDA å bruke «in vitro» testing - altså å teste hvordan legemiddelet løser seg opp i vann eller tarmvæske i laboratoriet. Hvis det matcher det originale, kan det kanskje erstatte en del av den dyre og tidkrevende kliniske studien.
Det finnes også nye metoder som «PBPK-modellering» - datamodeller som simulerer hvordan legemiddelet vil oppføre seg i kroppen basert på fysikk, kjemi og biologi. Denne teknologien vil bli viktig for komplekse legemidler som kremmer, injeksjoner eller neseblandinger - der tradisjonell blodmåling ikke gir et fullt bilde.
Men grunnlaget for alt dette er fortsatt bioavailability og bioequivalence. De to begrepene er ikke forandret - bare metodene for å måle dem blir bedre.
Hva bør du huske?
- Bioavailability handler om hvor mye og hvor raskt ett legemiddel blir absorbert.
- Bioequivalence er en sammenligning mellom to legemidler - og krever at AUC og Cmax ligger innenfor 80-125%.
- For de fleste legemidler er generiske alternativer like gode - og trygge.
- For smale terapeutiske vinduer (levothyroxin, warfarin osv.) bør du være oppmerksom og konsultere legen før du skifter.
- Det er ikke «merkevare = bedre». Det er «godkjent = trygt».
En generisk tablett er ikke en «kopie». Den er en identisk løsning - testet, målt, og godkjent med de samme strenge reglene som det originale legemiddelet. Og det er det som gjør det mulig å spare millioner på legemiddelkostnader - uten å risikere pasienters helse.
15 Comments
Tanja Brenden
Wow, dette er faktisk den tydeligste forklaringen av bioequivalence jeg har lest! Jeg har jobbet med legemidler i 15 år, og jeg har sett folk tro at generiske er 'mindre gode' - men nå forstår jeg endelig hvorfor det ikke er sant. Takk for at du tok deg tid til å skrive dette!
Det er viktig at flere får vite dette. Folk tror at billig = dårlig, men her er det bare smart økonomi med vitenskapelig grundlag. 👏
Torbjørn Kallstad
80/125-regelen er en joke. Hvorfor ikke 90/110? Eller 95/105? Det er bare en kompromiss som farmasøytiske selskaper har kjøpt inn hos regulatorer. Det er ikke vitenskap - det er politikk. 😏
OG ja, jeg vet at du tror du er smart fordi du skjønner AUC. Du er bare en av de som har lest Wikipedia.
Øyvind Skjervold
Det er viktig å huske at bioequivalence ikke er det samme som klinisk likeverdighet. Selv om AUC og Cmax er innenfor grensene, kan fyllestoffer påvirke tarmmikrobiommet, og det kan ha langtidseffekter vi ikke har målt enda.
Jeg er ikke mot generiske legemidler - jeg er mot overforenkling. Hver pasient er unik. Det er ikke bare tall - det er mennesker.
linn Bjorvatn
Denne 80/125-regelen er faktisk veldig intelligent statistisk design. Det er ikke en tilfeldig valgt grense - det er basert på log-normalfordeling av farmakokinetiske data. Mange forstår ikke at varians ikke er lineær, og da blir det feil å bruke ±20%.
Det er en av de rare tingene som virker intuitivt feil, men er matematisk perfekt. Det er faktisk vakrt når du ser det.
Filip overas
Har du tenkt på at alle disse studiene blir gjort av de samme farmasøytiske selskapene som produserer de originale legemidlene? Det er en stor konflikt av interesse. De kontrollerer dataene, laboratoriene, og selv utvalget av frivillige.
Det er ikke tilfeldig at bare 0,3% rapporterer problemer. De skjuler det. De har hele systemet kontrollert. Du tror du er trygg - men du er bare en del av et stort spill.
Tora Jane
Min mor skiftet til generisk levothyroxin og ble veldig trøtt. Ingen sa henne at det kunne være grunnen. Det tok 3 måneder før legen tenkte på det. Ikke fordi hun er dum - fordi ingen forteller deg dette.
Det er ikke bare om tall. Det er om å lytte.
Jorid Kristensen
Generiske legemidler? Nei takk. Jeg vil ikke ha noe som er laget av kinesere eller indiske fabrikker. Det originale er fra Tyskland - det er kvalitet. Du kan ikke kjøpe trygghet for 10 kroner. 😒
Ivar Leon Menger
Har du sett hva som skjer med warfarin når man skifter merke? Det er farlig. En venn min fikk blødning og ble i sykehus i 2 uker. Det var bare fordi de gav ham en annen tablett. Det er ikke bare tall. Det er liv. Vi må stoppe dette
og det er ikke bare meg som sier det
Kari Gross
Det er en feiloppfatning at bioequivalence betyr likeverdig. Det betyr bare at det er innenfor en statistisk grense. Ikke at det er identisk. Det er en viktig forskjell. Det er ikke bare et spørsmål om farmakokinetikk - det er et spørsmål om etisk ansvar.
Det er ikke bare en regel. Det er en moralisk avgjørelse.
Nina Kolbjørnsen
Det er så kjekt å se at noen faktisk forstår dette! Jeg jobber i apotek og hører hver dag folk si 'jeg vil ikke ha generisk, det er ikke like bra'.
Da viser jeg dem nettopp dette. De blir alltid overrasket. Det er så bra å kunne forklare det enkelt. Takk for at du gjorde det! 💪
Thea Nilsson
men faktisk 80/125 er jo litt mye ikke? jeg tenker at 90/110 hadde vært bedre. jeg har lest noe om at det er fordi de vil spare penger. og så er det jo de som har mye penger som bestemmer. det er ikke riktig.
men jeg er ikke ekspert så kanskje jeg har rett
Lars Ole Allum
Det er ikke 80/125, det er 80-125. Det er en konfidensintervall, ikke en grense. Du må skjønne forskjellen. Ellers forstår du ingenting. 😎
OG ja, jeg har lest alle studiene fra FDA og EMA. Du har ikke.
Kristoffer Griffith
Det er viktig å nevne at bioequivalence ikke er en garanti for at alle pasienter vil oppleve identisk effekt. Det er en gruppe-måling. For enkeltpersoner, spesielt med smale vinduer, kan små variasjoner ha store konsekvenser.
Det er ikke mot generiske legemidler. Det er mot å behandle alle som om de er like. Vi må passe på hver enkelt.
jan erik io
Det er interessant at du nevner PBPK-modellering. Det er en virkelig fremtidsteknologi. Jeg jobber med modellering av transdermale systemer, og det er fascinerende hvordan vi kan simulere absorpsjon uten blodprøver.
Men vi må være forsiktige. Biologisk variabilitet er ikke bare fysikk og kjemi. Det er også genetikk, kosthold, og mikrobiom. Vi er ikke bare maskiner.
Øyvind Skjervold
Takk for at du nevner PBPK-modellering. Det er det som virkelig kommer til å forandre alt. Men vi må ikke glemme at det er en modell - ikke virkeligheten. Den kan ikke ta hensyn til alle genetiske varianter, eller hvordan en pasient har sovnet de siste 3 nattene.
Det er en verktøy, ikke en løsning. Og vi må alltid ha en bakplan - klinisk overvåking. Ikke bare data.